Главная О компании Карта сайта Технологии для АПК Новые корма Рыбалка
2.2. Организмы, которые подходят для биогенной рециркуляции.
Подряд двукрылых включает насекомых, которых обычно называют простыми мухами или двукрылых, сходных с этой группой, которые включают в себя комаров, черных мух, мошек, плодовых мушек и домашних мух (Resh & Cardé, 2003). Насекомые из этого подряда классифицируются как вездесущие, потому что они имеют возможность приспосабливаться под любые условия на земле (Scholtz & Holm, 1985; Resh & Cardé, 2003).
В настоящем исследовании будут рассматриваться только насекомые из семейства Muscidae.
2.2.1 Семейство Muscidae
Комнатная муха (или Musca Domestica) принадлежит к семейству Muscidae и распространена повсеместно на земле, предпочитая мусорные кучи, фекалии, гниющие вещества и выделения из ран и язв (Scholtz & Holm, 1985; Resh & Cardé, 2003).
Личинки этих мух являются прекрасным источником протеина и других пищевых веществ (Téguia и др., 2002; Awoniyi и др., 2003; Zuidhof и др., 2003; Adeniji, 2007; Agunbiade и др., 2007; Hwangbo и др., 2009).
2.2.1.1 Химический состав личинок (опарышей) комнатной мухи
Основной жизненный цикл комнатной мухи показан на рисунке 1.
Сообщения разных авторам относительно химического состава отличаются между собой и причина этой вариативности кроется в зависимости химического состава от стадии развития насекомых (Калверт и Мартин, 1969; Inaoka и др., 1999; Newton и др,, 2004;.. Aniebo и др, 2008), способа сушки (Fasakin и др, 2003) и видом используемого субстрата (Ньютон и др., 1977).
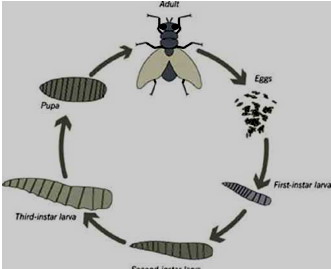
Рис. 1
Различия наблюдались как в химическом составе (Таблица 1), так и в аминокислотном составе (Таблица 3).
Таблица 1. Сравнение химического состава личинок мух и куколок (DM baisis), выращенных на различном сырье
|
Исследователи |
Calvert & Martin, 1969 |
Ogunji et al., 2006 |
Sogbesan et al., 2006 |
Aniebo et al., 2008 |
|
Кормовой субстрат |
Птичий помет |
Птичий помет |
Птичий помет |
Кровь КРС и отруби |
|
Стадия развития |
куколки |
Личинки в стадии предкуколки |
Личинки в стадии предкуколки |
Личинки 3-х дневного возраста |
|
Сырой протеин (%) |
63,1 |
37,5 |
50,4 |
47,1 |
|
Сырое волокно |
- |
- |
1,6 |
7,5 |
|
Жир |
5,3 |
19,8 |
20,6 |
25,3 |
|
Зола |
5,3 |
23,1 |
11,7 |
6,6 |
Различия в методах обработки и сушки (таблица 2), в основном обусловлены степенью разбавления исследуемого материала водой и содержанием в нем жира. В процессе обработки сырья из личинок мух и их куколок химический состав может быть скорректирован для того, чтобы сделать его более подходящим для кормления различных видов животных и птиц, а также различных стадий их развития.
В процессе переработки личинок исследователи (Fasakin др. (2003)), были способны варьировать содержание сырого протеина от 47,35% до 50,52%. Обезжиренные опарыши имели более высокие значения сырого протеина, так как удаление жира уменьшило общее количество продукта при полном сохранении остальных питательных веществ, что привело к увеличению сырого протеина (Shiau и др. , 1990). Это также отмечено в исследовании, проведенном Shiau и др. (1990), что обезжиривание соевой муки дает такое же увеличение количества сырого протеина и сырой клетчатки.
Таблица 2. Средние показатели содержания влаги, сырого протеина, сырого жира и золы в личинках мух в зависимости от методов обработки (Fasakin др., 2003) (± стандартная погрешность).
|
Метод обработки |
Влажность |
Сырой протеин |
Сырой жир |
Зола |
|
Гидролиз+ печная сушка |
8,06±0,05 |
45,6±0,02 |
13,28±0,03 |
13,2±0,02 |
|
Гидролиз+ сушка на солнце |
8,4±0,01 |
44,3±0,03 |
13,65±0,01 |
13,25±0,01 |
|
Гидролизация/обезжиривание + печная сушка |
7,56±0,02 |
46,7±0,01 |
6,28±0,01 |
13,3±0,01 |
|
Гидролизация/обезжиривание+сушка на солнце |
8,1±0,01 |
45,65±0,01 |
6,3±0,01 |
12,32±0,02 |
|
Обезжиривание+печная сушка |
9,2±0,01 |
45,75±0,03 |
7,0±0,02 |
13,35±0,0,02 |
|
Обезжиривание+ сушка на солнце |
9,65±0,04 |
45,1±0,05 |
7,4±0,01 |
13,45±0,02 |
|
Натуральные личинки+печная сушка |
8,25±0,02 |
43,45±0,03 |
14,3±0,03 |
14,35±0,02 |
|
Натуральные личинки+сушка на солнце |
8,55±0,04 |
43,3±0,01 |
14,35±0,03 |
14,65±0,01 |
В таблице 3 приведены различные данные по содержанию аминокислот от разных авторов. Большое различие в показателях наблюдается (таблица 3) в связи с тем, что методы определения этих аминокислот, которые использовали исследователи, существенно отличаются друг от друга.
Исследователи Aniebo и др. (2008) и Ogunji и др. (2006) подвергали гидролизу образцы перед анализом, а команда ученого Ogunji (2006) использовала высокоэффективную жидкостную хроматографию (ВЭЖХ). Aniebo с соавторами (2008) использовали последовательный мультианализатор аминокислот Technicon, чтобы определить конкретное содержание аминокислот.
Calvert & Martin (1969) использовали аминокислотные модели Spinco 120C- анализатора, в которых исследуемый образец образец освобождают от белка перед анализом. Согласно результатам исследований - Ogunji (2006) был единственным исследователем, который смог восстановить триптофан после анализов и только потому, что он использовал процедуру щелочного гидролиза, которая имеет более высокую скорость восстановления триптофана, чем методы кислотного гидролиза (Хугли & Moore, 1972).
Таблица 3 Аминокислотный состав личинок мух и куколок, выращенных на различных субстратах.
|
Исследователи |
Calvert & Martin, 1969 (% протеина) |
Ogunji et al., 2006 (% протеина) |
Aniebo et al., 2008 (% протеина) |
|
Кормовой субстрат |
Птичий помет |
Птичий помет |
Кровь КРС и отруби |
|
Стадия развития |
куколки |
Личинки в стадии предкуколки |
Личинки в стадии предкуколки |
|
Аминокислота |
|
||
|
Гистидин |
2,6 |
5,1 |
3,09 |
|
Аргинин |
4,2 |
4,6 |
5,8 |
|
Аспаргиновая кислота |
8,5 |
4,5 |
8,25 |
|
Треонин |
3,4 |
7,6 |
2,03 |
|
Серин |
3,2 |
3,3 |
3,23 |
|
Глутаминовая кислота |
10,8 |
6,8 |
15,3 |
|
Пролин |
3,1 |
- |
2,85 |
|
Глицин |
3,9 |
0,9 |
4,11 |
|
Аланин |
4,2 |
4,4 |
2,86 |
|
Цистин |
0,4 |
- |
0,52 |
|
Валин |
3,4 |
1,3 |
3,61 |
|
Изолейцин |
3,5 |
1,7 |
3,06 |
|
Лейцин |
5,3 |
5,6 |
6,35 |
|
Лизин |
5,2 |
4,4 |
6,04 |
|
Тирозин |
4,9 |
2,5 |
2,91 |
|
Фенилаланин |
4,2 |
10,2 |
3,96 |
|
Метионин |
2,6 |
- |
2,28 |
|
Триптофан |
- |
1,5 |
- |
|
Протеин (% сухого вещества) |
63,1 |
37,5 |
47,1 |
Таблица 4 показывает расчетный коэффициент незаменимой аминокислоты лизина. На практике метионин рассматривается в качестве первой лимитирующей аминокислоты для развития домашней птицы, с последующим превращением ее в лизин, который является незаменимым дополнением к кормам для птицы. Наличие этих аминокислот значительно увеличивает усвояемость белка (Schutte & De Jong, 2004).
В идеале аминокислотный состав кормов для бройлеров должен включать все незаменимые аминокислоты, а они должны быть выражены выражены в процентах от содержания в корме лизина, так как потребление последнего птицей (чего не скажешь о других аминокислотах) остается неизменным вне зависимости от других факторов окружающей среды, диетических и генетическиех факторов (NRC, 1994; Schutte & де Чен, 2004) , Результаты анализа, представленные исследователями Calvert & Martin (1969), имеют значение, наиболее близкое к идеальному по содержанию лизина в соотношении с остальными аминокислотами. Это указывает на важность анализа содержания аминокислот при использовании различных методов обработки личинок мух. На основе данных подобного анализа можно расчитать количество других источников протеина, которые должны входить в состав комбикормов вместе с мукой из личинок мух, для того, чтобы получить наилучший аминокислотный состав корма, который обеспечит оптимальное и эффективное развитие животных или птиц.
Таблица 4 Рассчет содержания аминокислоты - лизин, содержащегося в личинках мух по сравнению с идеальным содержанием для выращивания бройлеров.
|
Аминокислоты |
Calvert & Martin, 1969 |
Ogunji et al., 2006 |
Aniebo et al., 2008 |
Идеальный аминокислотный состав* |
|
Лизин |
100 |
100 |
100 |
100 |
|
Метионин+Цистин |
58 |
- |
46 |
75 |
|
Треонин |
65 |
177 |
33 |
65 |
|
Аргинин |
81 |
105 |
96 |
110 |
|
Триптофан |
- |
34 |
- |
18 |
|
Валин |
65 |
30 |
60 |
80 |
|
Изолейцин |
67 |
39 |
51 |
70 |
(*) Идеальное содержание аминокислот по определению Schutte & de Jong, 2004
Недавно опубликованное исследование, проведенное Aniebo & Owen в 2010 году показывает, что питательная ценность личинок мух в значительной степени зависит от стадии развития насекомого, а также от метода сушки (таблица 5). Результаты этого исследования показали, что содержание белка значительно (P <0,05) снизилась с возрастом. Авторы отмечают уменьшение содержания протеина с 59,6 - 54,2 до 50,8% и увеличению содержания жира от 22,4 - 23,9 до 27,3% при высушивании личинок двух, трех и четырехдневного возраста в сушильном шкафу (таблица 5).
Это явление может быть связано с тем фактом, что когда личинки подходят к фазе превращения в куколки (с дальнейшим превращение в насекомое) они начинают хранить больше энергии в виде липидов (Pearincott, 1960), а в стадии куколки будущее насекомое использует белки в ферментативных реакцииях для формирования слоя хитина (Крамер и Кога, 1986).
Aniebo и Owen в 2010 году также сообщили, что сушка личинок на солнце дает более низкие значения протеина, по сравнению с личинками высушенными в сушильных шкафах, а их жирность была выше, чем у личинок высушенных в печах.
Таблица 5 Среднее содержание сырого протеина и жира (± стандартное отклонение) в высушенных личинках мух, в зависимости от стадии развития и способа их сушки (Aniebo & Owen, 2010).
|
Стадия развития опарышей |
2-х дневный возраст (%) |
3-х дневный возраст (%) |
4-х дневный возраст (%) |
|
Сушка в печи |
|
|
|
|
Сырой протеин |
59,6±0,05 |
54,2±0,03 |
50,08±0,04 |
|
Жир |
22,4±0,14 |
23,9±0,14 |
27,3±0,35 |
|
Сушка на солнце |
|
|
|
|
Сырой протеин |
55,3±0,14 |
51,3±0,04 |
45,5±0,74 |
|
Жир |
25,2±0,14 |
28,0±0,14 |
32,0±0,35 |
Только немногие авторы сообщают минеральный состав личинок. В таблице 6 приведены минеральный состав личинок и куколок по сообщениям различных авторов. Разницу можно еще раз отнести к различиям в стадии развития, методов обработки, кормовых субстратов и витаминно-минеральных комплексов, которые использовались в кормлении животных.
Таблица 6 также показывает, что куколки (если используется один и тот же кормовой субстрат для культивирования опарышей) имеют гораздо более высокий показатель содержания минеральных веществ, чем личинки. Но в то же время личинки мух имеют гораздо большее содержание железа (Fe) - (1317.34ppm против 465ppm).
Fasakin др. (2003) также обнаружили, что способы сушки оказывают влияние на содержание минеральных веществ в личинках. Результаты их исследований показывают, что процесс гидролиза и обезжиривания личинок вызывает увеличение уровней Ca, Mg и Mn. Это, как уже упоминалось ранее, связано с тем, что с уменьжением содержания жиров количество основного продукта уменьшается, а концентрация минералов остается на том же уровне.
Таблица 6 Минеральный состав высушенных личинок мух и их куколок
|
Минеральный состав |
Teotia & Miller., 1974 |
Fasakin et al., 2003 |
|
Кормовой субстрат |
Птичий помет |
Птичий помет |
|
Стадия развития |
Куколки |
Личинки (возраст 96 часов) |
|
Метод сушки |
Сушка при температуре +65 в течение 12 часов в темном месте |
Гидролизация+сушка в печи |
|
Зола (%DM) |
11.9 |
13.2 |
|
P (%DM) |
1,43 |
- |
|
Ca (%DM) |
0,93 |
0,31 |
|
K (%DM) |
0,88 |
0,50 |
|
Na (%DM) |
0,56 |
0,29 |
|
Mg (%DM) |
- |
0,25 |
|
Mn (ppm2) |
370,00 |
47,38 |
|
Cu (ppm) |
34,00 |
25,71 |
|
Zn (ppm) |
275,00 |
48,87 |
|
Fe (ppm) |
465,00 |
1317,34 |
(DM)-массовая доля сухого вещества, 2- ppm - частей на миллион
Таблица 7 Состав жирных кислот в личинках и куколках по сообщениям различных авторов.
Эти данные наглядно показывают, что наиболее высокое содержание жирных кислот было получено в том случае, когда личинки питались смесью сухого молока, сахара и навоза (Hwangbo др., 2009). Этих незаменимых жирных кислот будет достаточно для роста бройлеров, поскольку бройлеры сильно нуждаются этих жирных кислотах, особенно в линолевой кислоте, в количестве не менее 0,2% от общего рациона (Zornig и др., 2001).
Таблица 7 Состав жирных кислот в личинках домашней мухи и ее куколках
|
Жирные кислоты (%) |
Hwangbo et al., 2009 |
Calvert & Martin, 1969 |
St-Hilaire et al., 2007 |
|
Стадия развития |
Опарыши (возраст личинок не указан) |
Куколки |
Куколки |
|
Кормовой субстрат |
Сухое молоко, сахар и птичий помет |
Специальная среда, созданная с использованием химических препаратов, для выращивания опарышей |
Коровий навоз |
|
Лауриновая кислота |
- |
- |
0,18 |
|
Миристиновая кислота |
6,83 |
3,2 |
2,56 |
|
Пальмитиновая кислота |
26,74 |
27,6 |
26,4 |
|
Пальмитолеиновая кислота |
25,92 |
20,6 |
13,56 |
|
Стеариновая кислота |
2,32 |
2,2 |
4,77 |
|
Олеиновая кислота |
21,75 |
18,3 |
19,7 |
|
Линолевая кислота |
16,44 |
14,9 |
17,83 |
|
Линоленовая кислота |
- |
2,1 |
- |
|
α- Линоленовая кислота |
- |
- |
0,87 |
|
Арахидоновая кислота |
- |
- |
0,07 |
|
Эйкозапентаеновая кислота |
- |
- |
0,05 |
|
Насыщенные жирные кислоты |
35,89 |
- |
- |
|
Ненасыщенные жирные кислоты |
64,11 |
- |
- |

